Anatomía, fisiología y neurobioquímica del dolor
Juan Pérez-Cajaraville - Clínica Universitaria de Navarra
Jose Ramón Ortiz-Gómez - Clínica Universitaria de Navarra
Servando López-Álvarez - Complexo Hospitalario Universitario A Coruña
DEFINICIÓN DE TÉRMINOS
El dolor a pesar de ser tan antiguo como el hombre, no es fácil de definir. En 1979 la IASP (Internacional Asociación para el Estudio del Dolor) lo define como “una experiencia sensorial y emocional desagradable, asociada con una lesión hística, presente o potencial, o descrita en términos de la misma”[1].
En esta definición se puede entrever que el dolor no es un mero síntoma sensorial, sino que debe entenderse como una experiencia aversiva perceptual y afectiva compleja, determinada tanto por las respuestas biológicas a los estímulos nociceptivos como por el significado de esos estímulos para cada sujeto, con interrelación de múltiples factores, tanto físico-sensoriales como psicológicos, emocionales y subjetivos.
Precisamente en esta variedad de factores que influyen sobre la vivencia del dolor por cada paciente y en el hecho que cada paciente experimenta el dolor de una forma propia, radica la necesidad de un enfoque terapéutico personalizado y multidisciplinar.
Antes de entrar a valorar los diferentes tipos de dolor, conviene definir una serie de conceptos que a menudo se usan erróneamente:
- Alodinia: percepción de un estímulo sensorial no dolorosos como dolor.
- Analgesia: ausencia de percepción dolorosa.
- Anestesia: ausencia de todo tipo de sensaciones, incluyendo el dolor.
- Anestesia dolorosa: dolor en el área que no tiene sensación dolorosa.
- Disestesia: sensación desagradable o anormal con o sin estímulo.
- Hipoalgesia: respuesta disminuida a un estímulo doloroso.
- Hiperalgesia: respuesta aumentada a un estímulo doloroso.
- Hiperestesia: respuesta aumentada a la estimulación leve.
- Hiperpatía: presencia de hiperalgesia, hiperestesia y alodinia, en general aunadas a sobrereacción y persistencia de la sensación posterior al estímulo.
- Hipoestesia: respuesta disminuida a la estimulación leve.
- Neuralgia: dolor en el área de inervación de un nervio.
- Parestesia: percepción de una sensación anormal sin un estímulo aparente.
- Radiculopatía: anormalidad funcional de una o varias raíces nerviosas.
TIPOS DE DOLOR
Motivado por esta dificultad de definición, y por la extraordinaria variedad de sus posibles manifestaciones, el dolor se ha clasificado tradicionalmente de varias formas: agudo–crónico, nociceptivo–neuropático, físico-psicógeno, central–periférico, referido–de proyección.
Todas estas clasificaciones guardan cierto grado de imprecisión, ya que por ejemplo, aunque inicialmente un dolor pueda ser agudo, si la causa que lo originó persiste, evolucionará hacia la cronicidad, siempre sin olvidar la interacción entre diversos factores moduladores, especialmente los psicoafectivos. La clasificación más habitual es la de dolor agudo – dolor crónico[2].
A. Dolor agudo
Se suele definir como aquel debido a estímulos nocivos originado por lesiones, enfermedades o función anormal de vísceras o músculos. Es de breve duración (menor de 6 meses) y cede al remitir la causa originaria.
Se ha considerado siempre como un mecanismo de defensa ante un daño tisular que genera una activación del sistema nociceptivo, ejerciendo un cierto papel protector al servir de aviso al paciente de la existencia de una lesión orgánica. Por este motivo también se le ha denominado dolor nociceptivo, dolor señal o dolor síntoma.
Importancia del dolor agudo
La importancia del dolor agudo postoperatorio radica en su alta frecuencia, en su inadecuado tratamiento y en las repercusiones que tiene en la evolución y en la recuperación del paciente.
Se estima que, independientemente del tipo de intervención, el 30% de los pacientes experimentan dolor leve tras la cirugía, el 30% dolor moderado y el 40% dolor severo. El dolor postoperatorio es más frecuente y más severo tras la cirugía torácica, abdominal y lumbar; también la cirugía extensa en columna y en huesos largos puede ser muy dolorosa.
El dolor postoperatorio inadecuadamente tratado puede comprometer la recuperación del paciente al aumentar la morbi-mortalidad y prolongar el ingreso hospitalario. En ocasiones, el dolor agudo pierde su función protectora y se convierte en un problema en sí mismo, como sucede con un dolor agudo que no se resuelve a pesar de la remisión de la causa original o por un tratamiento inadecuado.
Tipos de dolor agudo según el mecanismo fisiopatológico
El dolor agudo, sobre todo el postoperatorio, generalmente es de tipo nociceptivo somático, aunque pueden asociarse componentes viscerales y neuropáticos, sobre todo en enfermos vasculares y neuroquirúrgicos. Cuando ello ocurre, estos signos suelen estar ya presentes antes de la intervención. La importancia de caracterizar adecuadamente el tipo de dolor presente radica en la elección de la estrategia terapéutica más adecuada en cada caso[3].
El dolor agudo también puede clasificar en superficial, somático profundo y visceral:
Dolor superficial, cutáneo o periférico Es debido a estímulos nociceptivos (térmicos, mecánicos, eléctricos o químicos) originados en la piel, mucosas o tejido celular subcutáneo. Suele estar bien localizado y se describe de carácter pulsátil, punzante (en casos de estimulación breve) o quemante (si la estimulación es mantenida). A veces se acompaña de otros síntomas tales como hiperalgesia, hiperestesia, analgesia, etc.
Dolor somático, profundo o central
Está originado a nivel osteoarticular, y se describe de carácter sordo y mal localizado. A mayor intensidad y duración de la estimulación, más difuso es el dolor.
Dolor visceral
Un tipo de dolor central muy característico es el dolor visceral, que es vago, profundo, a veces aparece sin tener relación directa con lesiones, acompañado de reflejos autónomos tales como la variación de la frecuencia cardiaca, náuseas, sudoración. Es un tipo especial de dolor central debido a lesión o disfunción de un órgano interno o sus serosas[4]. No todas las vísceras son sensibles al dolor. El dolor visceral es de carácter sordo, difuso, mal definido, mal localizado, que se irradia, localizado o referido a un área distante, acompañado frecuentemente de cortejo neurovegetativo, con náuseas, vómitos, sudoración e incrementos de la presión arterial y frecuencia cardiaca.
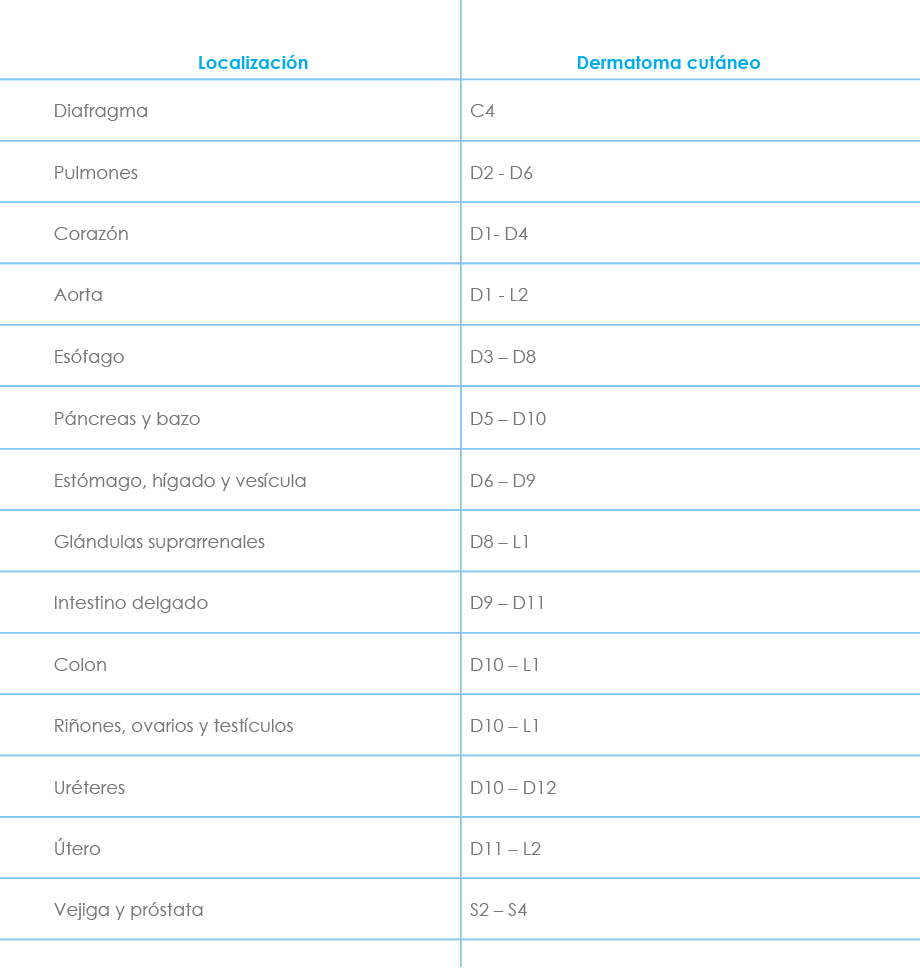
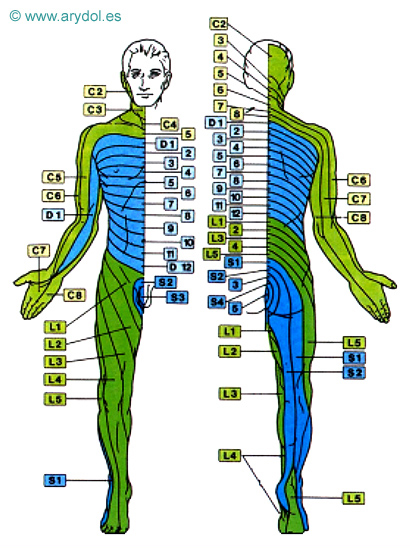
Conviene también diferenciar entre el dolor de proyección y el dolor referido. El primero suele deberse a irritación ganglionar y/o radicular posterior, manifestándose con hipoestesia y parestesias (hernia discal o neuralgia radicular). Se explica por la ley de Ruch, que dice que el estímulo que actúa sobre una vía sensorial, en cualquier punto situado centralmente respecto al órgano receptor, origina una sensación proyectada hacia la periferia que no se percibe en el lugar de la estimulación. El dolor referido (o parietal verdadero) es un dolor de tipo visceral que se percibe en una parte externa en correspondencia con el órgano interno estimulado. Se cree debido en parte a la convergencia de impulsos aferentes viscerales y somáticos desde el sistema nervioso central y por otro lado a patrones de desarrollo embriológico y migración tisular. Se caracteriza por hiperestesia, hiperalgesia cutánea y/o muscular, e incluso dolor muscular a la palpación superficial (colecistitis, angina de pecho...). La localización más frecuente de los dermatomas implicados se expone a continuación (Tabla 1) junto a un esquema de la distribución metamérica (Fig. 1).
Tabla 1: Localización más frecuente de los dermatomas implicados en el dolor referido.
Fig. 1
Distribución metamérica
A. Dolor crónico
El dolor crónico se define como aquel que persiste más allá de 6 meses (IASP) a pesar de la desaparición de las causas que lo originaron. Bonica lo define como un dolor que persiste al menos un mes más que la lesión causal y que permanece una vez que dicha lesión desaparece. Llegado a este punto, el dolor crónico pierde el carácter de aviso o alarma protectora del dolor agudo y se torna en un problema en sí mismo, convirtiéndose en una enfermedad propia o en parte importante de ésta. Es frecuente la aparición de alteraciones y trastornos emocionales (labilidad, depresión), conductuales, del sueño y del apetito, deterioro físico progresivo, respuesta neuroendocrina al estrés atenuada (o ausente), disminución de la actividad y con frecuencia efectos secundarios de los tratamientos administrados. Todo conduce a menudo a erigirse el dolor como el aspecto esencial de la vida del paciente, cuya existencia gira en torno a éste, en ocasiones de forma dramática. El dolor crónico también ha sido catalogado de varias formas: Dolor agudo recurrente: Son episodios de dolor agudo que se repiten periódicamente durante toda la vida del sujeto o durante un período prolongado (Migrañas). Dolor maligno o crónico agudo: Es un dolor continuo de duración limitada. Dura meses o años, acabando generalmente en curación o con la muerte del paciente. Es el caso del dolor neoplásico.
Dolor crónico benigno o no maligno: Debido a causas no neoplásicas y no potencialmente mortales. Esta clasificación es poco afortunada, porque un dolor crónico e invalidante como en el observado en caso del miembro fantasma o la artritis reumatoide nunca es benigno para el paciente, independientemente de cual sea la causa.
Hay otras clasificaciones más o menos artificiosas, como la de dolor físico vs dolor psicógeno, o la de dolor nociceptivo vs dolor neuropático. Esta última es la que puede tener mayor interés.
C. Dolor nociceptivo
Es aquel dolor que aparece en los individuos normales después de un estímulo que produce daño o lesión de órganos somáticos o viscerales5. Se denomina también dolor normal o sensorial, y es el resultado último de la activación de un sistema sensorial específico que abarca nociceptores específicos, vías ascendentes y córtex cerebral. Ej. El dolor percibido ante un pinchazo con una aguja.
D. Dolor neuropático
Se denomina también dolor anormal o patológico6. Sólo aparece en una minoría de los individuos y está motivado por enfermedad o lesión del sistema nervioso central o periférico. Es un dolor persistente, rebelde al tratamiento, a veces de aparición tardía después de la lesión. Se observa una reacción anormal del sistema nociceptivo hasta tal punto que a veces, hay ausencia total de relación causal entre la lesión tisular y el dolor7. Un buen ejemplo, es el dolor por avulsiones traumáticas de plexos nerviosos.
BASES ANATOMOPATOLÓGICAS DE LA SENSIBILIDAD Y DE LA NOCICEPCIÓN
Existe sensibilidad cuando una excitación en un punto cualquiera del organismo alcanza un centro nervioso y consigue en éste una respuesta[8]. Sherrington, en el siglo XIX clasifica los distintos tipos de sensibilidad teniendo en cuenta el campo donde se produce el estímulo; sensibilidad exteroceptiva, interoceptiva y propioceptiva. Desde un punto de vista clínico se puede hablar de sensibilidad superficial (tacto, dolor y temperatura) y de sensibilidad profunda (ósea, muscular, tendinosa y articular). Diferenciándose incluso en esta última dos tipos: una sensibilidad profunda inconsciente (que regula inconscientemente la ejecución de todo movimiento complejo y combinado como marcha, equilibrio, sinergia muscular) y la sensibilidad profunda consciente (sentido de posición, de movimiento, situación espacial, vibración). Asimismo se ha establecido una jerarquía cualitativa de las diferentes sensibilidades superficiales, diferenciando la simple, elemental (sensibilidad protopática), de la compleja, discriminativa (sensibilidad epicrítica)[9].
Hasta ahora, queda claro, que no podemos hablar de un dolor único, o enfocarlo desde un objetivo simplista. La palabra dolor se aplica para definir un rango muy amplio de sensaciones no placenteras, tanto consideradas normales (dolor nociceptivo) como anormales (dolor neuropático).
Se han propuesto numerosas teorías que tratan de explicar el fenómeno doloroso, como la teoría de la especificidad (el dolor siempre se debe a la activación secuencial de neuronas específicas encargadas de la transmisión nociceptiva), la teoría del patrón (que niega la existencia de vías especificas de la transmisión nociceptiva y la explica mediante la aparición de patrones espaciotemporales transmitidas por cadenas neurosensoriales no específicas). Ninguna de ellas es capaz de explicar satisfactoriamente por separado la variedad del estímulo doloroso. Así, la teoría del patrón queda en evidencia ante la demostración de la existencia de nociceptores específicos, o la teoría de la especificidad no puede justificar la aparición de estados dolorosos anormales ante la estimulación de receptores de bajo umbral (hiperalgesia)[10].
Por esto, se ha llegado a postular una teoría intermedia que establece 3 fases en la percepción del dolor. La primera fase se correspondería al dolor nociceptivo (dolor en respuesta a una lesión). En la segunda fase, debido a la presencia de un estímulo nocivo mantenido y la liberación de mediadores inflamatorios, se produce una hipersensibilización a nivel central, con descargas aferentes persistentes. La tercera fase abarca aquellos dolores neuropáticos donde además existe una lesión nerviosa, con respuestas completamente anormales ente los estímulos nocivos, o incluso en ausencia total de ellos.
No hay que olvidar los factores que modulan el dolor, y que a menudo son de tipo conductual y afectivo. Por esto, algunos autores hablan de percepción dolorosa y no de sensación dolorosa, aspecto que añade mayor complejidad en la anatomofisiología del dolor, al incluir el tálamo, el sistema límbico, el hipotálamo o la corteza cerebral. Tenemos por tanto, implicación de los receptores de dolor (nociceptores), vías aferentes de transmisión nerviosa a la médula espinal, vías de conducción ascendentes de la médula espinal, y los centros superiores del dolor: núcleos talámicos, hipotálamo, sistema límbico y córtex.
A continuación revisaremos la anatomía y la función cada uno de estos integrantes en la transmisión nociceptiva.
A. El sistema periférico: los nociceptores
Por receptor se entiende toda aquella estructura capaz de modificar su umbral de percepción para una clase de excitación, bien aumentándolo o disminuyéndolo. El cuerpo humano dispone de una amplia serie de receptores sensoriales que responden a cambios electromagnéticos (receptores retinianos), químicos (quimiorreceptores), presión (mecanorreceptores) o temperatura (termorreceptores)[11].
Los nociceptores, mal llamados en ocasiones receptores del dolor, responden ante la existencia de lesiones tisulares. Carecen de una estructura histológica bien definida como sucede con otros receptores sensoriales, y parecen depender de las terminaciones nerviosas libres de las fibras mielínicas finas A-delta y fibras C-amielínicas, correspondientes a los extremos de las ramificaciones dendríticas de las neuronas de los ganglios raquídeos o de los pares craneales.
Su respuesta es irregular o ausente ante estímulos que no alcanzan el umbral mínimo para ser discernidos por el organismo como un estímulo doloroso. Este umbral, depende en parte de cada individuo (hay personas con mayor tolerancia al dolor) o de la zona estimulada (La cornea es más sensible que la piel ante estímulos lesivos).
1. Nociceptores cutáneos
A nivel cutáneo, las fibras A-delta suelen corresponderse a mecanorreceptores de alto umbral de activación, con campos de recepción emplazados en múltiples puntos de la piel. Son terminaciones sensoriales de fibras mielínicas de diámetro pequeño y velocidades de conducción de 5 a 30 m/s. Sólo suelen responder ante estímulos mecánicos nocivos de gran intensidad, respondiendo muy bien ante pinchazos o pellizcos cutáneos. Son de amplia velocidad de conducción y capacidad de adaptación lenta, aunque a medida que aumenta la intensidad del estímulo, aumenta el nivel de respuesta[12].
Las fibras C-amielínicas tienen velocidades de conducción inferiores a 1.5 m/s y se relacionan generalmente con los nociceptores polimodales, caracterizados por activarse ante estímulos mecánicos, térmicos o químicos (sustancias liberadas por el daño tisular como histamina, capsaicina, potasio…), tener campos de recepción pequeños, adaptarse lentamente y responder con más intensidad a estímulos de larga duración.
En ocasiones, cuando un estímulo sobrepasa una intensidad normal y tolerable, se torna lesivo, activando receptores sensoriales, como sucede con los termorreceptores, que se activan ante cambios de temperatura menores o iguales a un grado centígrado en un rango de entre 30 y 40°C. Serían los receptores al frío representados por los bulbos de Krause, de disposición muy superficial en el tejido conjuntivo subdérmico, y los del calor, constituidos por los corpúsculos Golgi-Manzonni y los de Ruffini. Habitualmente informan de los cambios térmicos normales. Sin embargo, algunos de ellos producen información nociceptiva ante estímulos térmicos de gran intensidad (47-51°C); a este último grupo se les denomina termonociceptores. De forma similar, se ha descrito la existencia de mecanonociceptores de alto dintel de activación de tipo C y mecanotermonociceptores (fibras A-delta y C que responden ante estímulos mecánicos y/o térmicos de gran intensidad)[13].
2. Nociceptores musculares
A nivel muscular, se pueden observar receptores de tracción y distensión muscular, así como nociceptores con respuesta a la isquemia, a estímulos mecánicos de gran intensidad y a la bradicinina y la serotonina. Estos nociceptores pueden ir asociados a las fibras A-delta (actúan tanto como mecanorreceptores de alto umbral de activación, como nociceptores polimodales) o asociados a las fibras C (suelen actuar como nociceptores polimodales). Los primeros también se denominan fibras del grupo III en nervios musculares y responden a sustancias algógenas como los iones de potasio, la bradicinina o la serotonina, además de a contracciones sostenidas del músculo. Las fibras amilínicas (fibras musculares del grupo IV o fibras C) responden a estímulos como el calor, la presión o la isquemia muscular.
3. Nociceptores osteotendinosos
Existen nociceptores en el periostio y en la esponjosa del hueso con fibras A-delta y C. En las articulaciones hay terminaciones sensoriales de fibras aferentes amielínicas que responden a mediadores hísticos liberados durante el daño tisular y son los responsables de la sensibilización algógena tisular durante la inflamación. Son los propioceptores: fibras aferentes de los husos neuromusculares (la y II); de los tendones (órganos tendinosos de Golgi; receptor tipo III de Skoglund, corpúsculos tendinosos (Ib)); de la cápsula articular y fascias (similares a los corpúsculos de Ruffini, receptores tipo I de Skoglund); de la cápsula y huesos (similares a los corpúsculos de Paccini, receptores tipo II de Skoglund); terminaciones nerviosas, libres, no mielinizadas, en la cápsula, fascia y ligamentos (receptores tipo IV de Skoglund, parecen ser sensibles al ácido láctico y han sido interpretadas como receptores a los estímulos dolorosos). Son más numerosos en la parte distal de los miembros (dedos).
4. Nociceptores viscerales
Se ha demostrado su existencia en el corazón, pulmones, vías aérea y biliar, testículos, uréteres y útero. Las vísceras gastrointestinales están inervadas por receptores sensoriales no específicos. Los nociceptores viscerales se activan por estímulos mecánicos (distensión y tracción) o químicos (inflamación), y son conducidos por fibras aferentes viscerales amielínicas de los nervios simpáticos, de las cuales sólo aproximadamente un 19% llega a la médula. Los receptores viscerales responden sólo ante estímulos nocivos que superan el umbral de nocicepción, mientras que los receptores sensoriales inespecíficos responden tanto ante estímulos inocuos como ante estímulos nocivos supramáximos.
5. Fibras nerviosas centrípetas
Los nociceptores ejercen una función doble: por un lado la transmisión aferente de la información nociceptiva y por otra parte una acción trófica eferente relacionada con los estados iniciales de la inflamación tisular además de la transmisión eferente de la información nociceptiva. Esta última función queda manifiesta en caso de lesiones o enfermedades que producen denervación, como en el caso de las distrofias cutáneas diabéticas, y parece depender del reflejo axónico, que induce vasodilatación cutánea y un incremento de la permeabilidad capilar inducido por la liberación de sustancias vasoactivas contenidas en las terminaciones nociceptivas aferentes, como la sustancia P, leucotrienos y bradicinina, que a su vez inducen la liberación de histamina y prostaglandinas por los mastocitos circundantes.
Además de participar en la reacción inflamatoria, estas sustancias contribuyen al establecimiento de los mecanismos de hiperalgesia primarias y a la activación de nociceptores en reposo.
B. Vías de la sensibilidad
Modernamente muchos autores pretenden distinguir una sensibilidad elemental (tacto, dolor y cinestesia, que seguirían unas vías anatómicas distintas) de una percepción diferente que permite valorar diferencias de intensidad, de localización y de extensión y que implica una actividad de análisis cortical. Para estos autores, la sensibilidad elemental no necesitaría llegar a la corteza cerebral para hacerse consciente.
Hay que señalar, no obstante, que en la periferia las sensibilidades están disociadas, ya que los órganos receptores son distintos, pero todas ellas llegan a la médula por un nervio periférico, y que una vez que éstos han penetrado en la médula (raíz posterior) o en el encéfalo, y se han distribuido sus fibras, se produce la independencia y separación de las vías de la sensibilidad En conjunto, las vías de la sensibilidad reciben el nombre de vías ascendentes y están representadas por el conjunto de neuronas que transmiten la sensibilidad de los distintos receptores de los tegumentos, mucosas y órganos a la corteza cerebral.
A pesar que sólo existe una sensibilidad, resultante de la integración de todos los estímulos recibidos, es útil clasificarlo en tres grupos:
- Sensibilidad exteroceptiva o superficial: nos informa de la acción de los agentes físicos externos y comprende: tacto, dolor, temperatura y presión. Dentro de ésta existe una sensibilidad grosera de poco análisis (sensibilidad protopática) y existe una sensibilidad discriminativa, que nos permite el análisis fino e integrado de la sensibilidad exteroceptiva (sensibilidad discriminativa o epicrítica). Esta bajo control somático.
- Sensibilidad propioceptiva o profunda, es decir, la propia de nuestro cuerpo en relación a nuestro entorno. Procede fundamentalmente del aparato locomotor. En ella se distinguen dos componentes: consciente e inconsciente. También se encuentra bajo control somático.
- Sensibilidad interoceptiva, que comprende la sensibilidad de las vísceras, vasos y de las serosas. Está controlada por el sistema vegetativo.
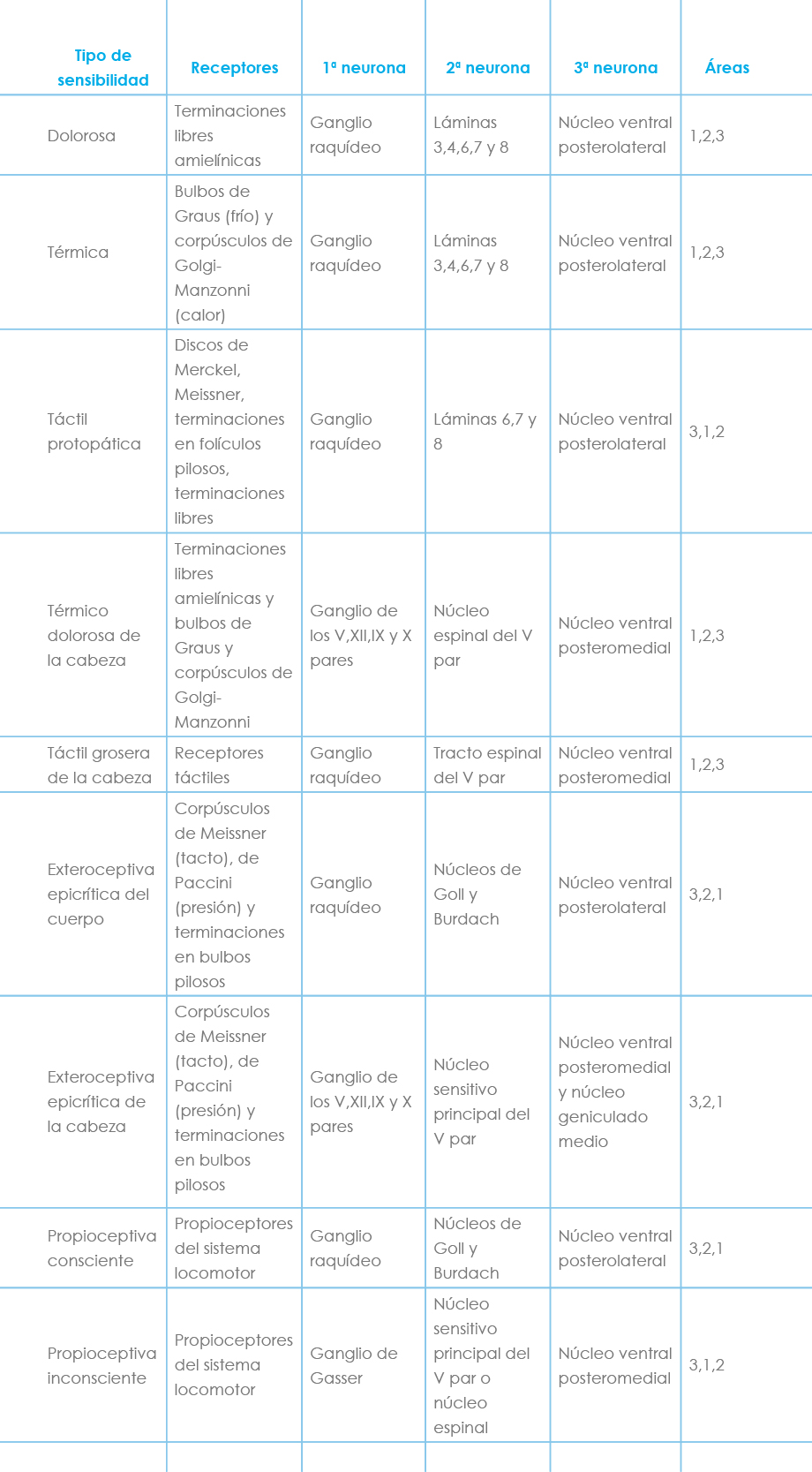
En todas las vías de la sensibilidad general, sea superficial o profunda, existe esencialmente la superposición de tres neuronas:
- Neurona sensitiva: está representada por las células de los ganglios raquídeos o de los nervios craneales, con su prolongación periférica y su prolongación central, que se introduce en el sistema nervioso central. Se relaciona por su prolongación periférica con los receptores.
- Segunda neurona (espino o bulbotalámica): su célula se encuentra en los núcleos sensitivos del bulbo o del asta posterior de la médula, y su prolongación central alcanza el tálamo, mientras que su prolongación periférica está sinaptando con la prolongación que procede del ganglio espinal.
- Tercera neurona (talamocortical): está situada en el tálamo y sus cilindroejes alcanzan la corteza parietal.
Sensibilidad exteroceptiva o superficial protapática:
La sensibilidad exteroceptiva o superficial protapática puede dividirse en nervios periféricos que inervan el tronco y las extremidades) y pares craneales que inervasn la cabeza.
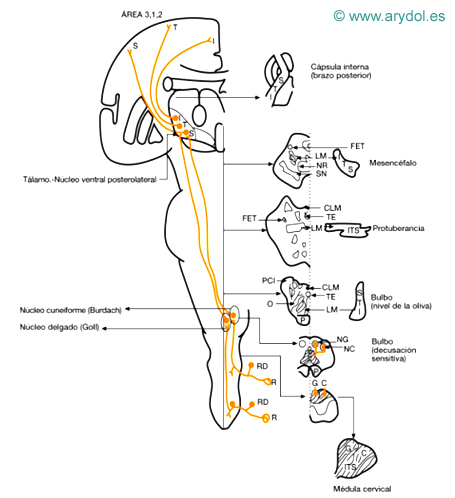
Sensibilidad dolorosa (Fig. 2)
a) Receptores: Son terminaciones nerviosas libres, subepidérmicas y principalmente amielínicas.
b) Primera neurona: Situada en el ganglio raquídeo, la prolongación central entra en la médula formando la parte lateral de la raíz posterior; se introduce en la zona de Lissauer y su prolongación ascendente va a terminar en la segunda neurona.
c) Segunda neurona: Tradicionalmente se dice que está ubicada en el núcleo espongioso del asta posterior (láminas III y IV). Sin embargo, los estudios con trazadores celulares no han demostrado ninguna fibra que originándose en las láminas III y IV se introduzca en los fascículos espinotalámicos.
Las fibras que van a dar lugar a los fascículos espinotalámicos se originan en las láminas VI y VII y algunas en la VIII; las células de las láminas III y IV responden a los estímulos dolorosos térmicos y táctiles groseros, pero no se ha logrado demostrar la conexión entre estas láminas y las láminas donde se van a originar los fascículos espinotalámicos. Habría, pues, que admitir que existe una conexión que aún no está bien determinada. El axón procedente de las láminas VI, VII y VIII cruza la línea media por la comisura blanca anterior y asciende contralateralmente por el cordón anterolateral de la médula; la disposición de las fibras en este fascículo es somatotópica, de tal forma que las fibras que proceden de los segmentos más inferiores están situadas más dorsales y superficiales. Estas fibras, una vez que han cruzado la línea media, constituyen el fascículo espinotalámico lateral. Terminan las fibras en la tercera neurona.
Los fascículos espinotalámicos están formados por 2 ramas: el fascículo espinotalámico lateral (sensibilidad térmica y dolorosa) y el fascículo espinotalámico anterior o ventral (sensibilidad táctil protopática).
El primero está compuesto por cuatro tipos de neuronas:
1. Neuronas de rango estrecho (o de clase I): se encuentran en las láminas IV y V y sólo responden a estímulos táctiles inocuos.
2. Neuronas profundas de las láminas IV y V: responden a estímulos propioceptivos.
3. Neuronas de amplio rango (o de clase II): se encuentran en la lámina V y responden a estímulos mecánicos, térmicos y químicos de origen cutáneo, muscular y visceral.
4. Neuronas nociceptoras (o de clase III): localizadas en la lámina I, sólo responden a estímulos nociceptivos de alta intensidad.
Los axones de estas neuronas cruzan la línea media de la médula por la comisura anterior para llegar al cordón anterolateral del lado opuesto, donde se hacen ascendentes y van siendo desplazadas superficialmente a medida que se incorporan los segmentos más craneales. Ambos fascículos (lateral y anterior) discurren unidos hasta el bulbo raquídeo donde el fascículo anterior se une a las fibras del sistema lemniscal, que conduce la sensibilidad táctil epicrítica y propioceptiva consciente. A medida que las fibras de este haz ascienden hacia el tálamo se produce una notable reducción en su número, especialmente en el tronco del encéfalo. Por su parte, el fascículo lateral (nociceptivo) atraviesa sin interrupción el bulbo, la protuberancia y el pedúnculo cerebral, donde vuelve a unirse al fascículo anterior para terminar ambos en el núcleo posteroventral del tálamo.
d) Tercera neurona: está situada en el tálamo, en el núcleo ventral posterolateral. El fascículo espinotalámico lateral, en su discurrir hacia el tálamo, está situado en el cordón lateral de la médula en su parte más anterior, situándose profundo a los fascículos espinocerebelosos centrales y lateral al reticuloespinal lateral. Mantiene la misma disposición respecto al fascículo espinocerebeloso ventral a lo largo de toda su trayectoria hasta la protuberancia; a este nivel se adosa la parte más lateral de la cinta de Reil media. Desde el núcleo ventral posterolateral saldría la proyección cortical, que terminaría en las áreas 3, 2 y 1 a través del brazo posterior de la cápsula interna. Para muchos autores esta sensibilidad dolorosa no necesitará llegar al tálamo para hacerse consciente.
A nivel mesencefálico en el fascículo espinotalámico lateral se presentan dos componentes diferenciados: el neoespinotalámico y el paleo espinotalámico. El primero es filogenéticamente más avanzado que el segundo (de ahí su nombre) y parece estar formado por fibras de gran longitud que contactan directamente con los núcleos ventroposterolaterales y posteriores del tálamo. Es una vía de conducción rápida relacionada con el dolor agudo o primer dolor.
Por su parte, el componente paleoespinotalámico está formado por fibras amielínicas de trayecto corto con múltiples sinapsis y por tanto con una velocidad de conducción mucho más lenta. Se cree que este sistema participa en la transmisión del dolor difuso o segundo dolor.
Sensibilidad térmica (Fig. 2)
La vía de la sensibilidad térmica se superpone en todo a la vía nociceptiva; esto es, es conducida a través del fascículo espinotalámico lateral. Sus fibras, dentro del fascículo espinotalámico lateral, se sitúan profundas a las fibras que llevan el estímulo doloroso y guardan la misma disposición somatotópica que ellas.
Sensibilidad táctil protopática (Fig. 2)
a) Receptores: pueden ser discos táctiles de Merkel, corpúsculos táctiles de Meissner, terminaciones nerviosas libres en la raíz de los folículos pilosos o terminaciones nerviosas libres intraepiteliales.
b) Primera neurona: célula pseudomonopolar de los ganglios raquídeos. Su prolongación central se introduce en la médula a través de la parte medial de la raíz dorsal y termina en la segunda neurona.
c) Segunda neurona: en muchos tratados se ubica en el núcleo espongioso del asta dorsal (láminas III y IV), pero de él no se ve surgir ninguna fibra que se introduzca en el fascículo espinotalámico anterior. Sí se ven aparecer fibras que se integran en este fascículo de las láminas VI, VII y VIII. Estas fibras cruzarían la comisura blanca anterior integrándose en el fascículo espinotalámico anterior, que discurre por el cordón anterior de la médula, profundo al espinotectal y lateral al reticuloespinal medial y ventral al espinotalámico lateral. Asciende y en el bulbo se sitúa dorsolateral a la oliva, donde se confunde con el espinotalámico lateral; a nivel de la protuberancia se une a la parte lateral de la cinta de Reil media; en su trayecto por el tronco del encéfalo da colaterales al sistema reticular, terminando en la tercera neurona.
d) Tercera neurona: situada en el tálamo núcleo ventral posterolateral, de donde surge la proyección cortical al área 3, 1 y 2. Para muchos autores este tipo de sensibilidad no necesitaría llegar a la corteza para hacerse consciente. Algunos autores incluyen dentro de este fascículo la sensibilidad a la presión grosera. El fascículo espinorreticular termina en la protuberancia y en el bulbo; el fascículo espinotectal, en el mesencéfalo; los fascículos espinotalámicos, en el tálamo.
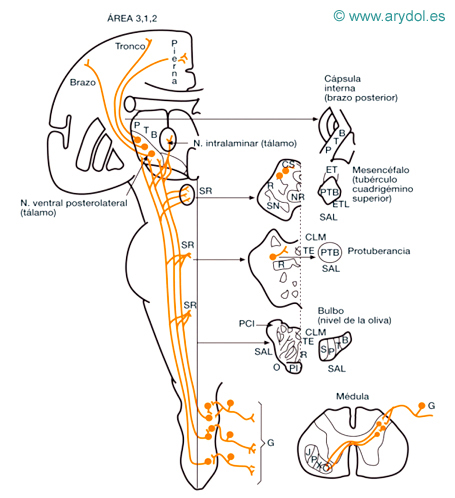
Fig. 2
Vías anatómicas de la sensibilidad exteroceptiva
B miembro superior
CLM cinta longitudinal medial
CS tubérculo cuadrigémino superior
ET fascículo espinotectal
ETL fascículos espinotalámicos
G ganglio raquídeo (neurona)
NR núcleo rojo
O oliva bulbar
P miembro inferior
PL fascículo piramidal
R cinta Reil media
S región sacra
SAL sistema anterolateral
SN sustancia negra
T región torácica
TE fascículo tectoespinal
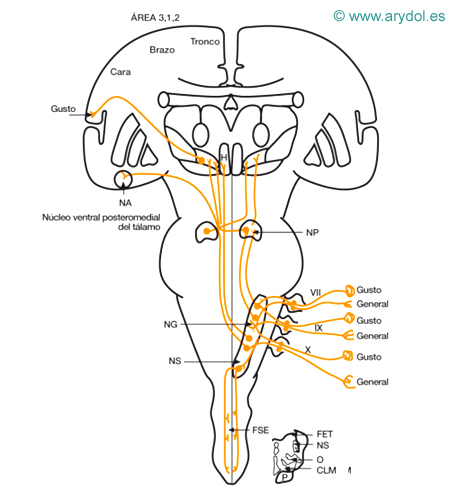
Sensibilidad dolorosa y térmica de la cabeza (Figs. 3 y 4)
La sensibilidad exteroceptiva de la cabeza se recoge fundamentalmente por el V par, con la excepción de la zona de Ramsay-Hunt (recogida por el VII, IX y X pares).
a) Receptores: terminaciones nerviosas libres amielínicas, bulbos de Krause (frío), corpúsculos de Golgi-Manzonni y Ruffini (calor).
b) Primera neurona: situada en los ganglios del V, VII, IX y X pares. Su prolongación central acompaña a cada nervio, y al llegar al tronco del encéfalo se introducen en el tracto espinal del nervio trigémino, alcanzando la segunda neurona.
c) Segunda neurona: situada en el núcleo espinal del trigémino, en la parte más superficial del mismo; desde aquí surge el axón, que, cruzando la línea media, va a constituir el haz secundario ventral del trigémino, que se dispone medial y profundo al fascículo espinotalámico lateral. Asciende y se sitúa adosado a la zona profunda de la cinta de Reil media para terminar en la tercera neurona.
d) Tercera neurona: situada en el tálamo a nivel del núcleo ventral posteromedial. De este núcleo surge la proyección cortical hacia las áreas 1, 2 y 3, al igual que con los sistemas espinotalámicos; no parece necesario que alcance la corteza para hacerse consciente.
Sensibilidad táctil protopática de la cabeza (Figs 3 y 4)
a) Receptores: disco táctil de Merkel, corpúsculo táctil de Meissner, terminaciones nerviosas libres en los bulbos pilosos, terminaciones nerviosas libres intraepiteliales.
b) Primera neurona: su ubicación y el recorrido de su proyección central son iguales que los de la sensibilidad térmica y dolorosa de la cara.
c) Segunda neurona: núcleo del tracto espinal del trigémino, en su zona medial o espongiosa; desde aquí el trayecto, situación y la localización de la tercera neurona son idénticas a las de la vía de la sensibilidad térmica y dolorosa de la cara.
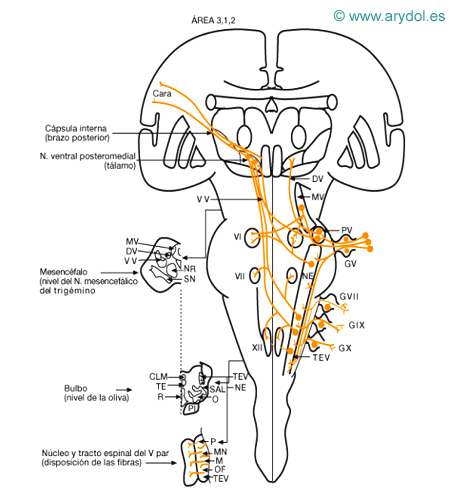
Vías sensitivas de los pares craneales y conexiones de sus núcleos sensitivos
V masticatorio trigémino
VI motor ocular lateral
VII motor especializado del facial
XII hipogloso
CLM cinta longitudinal medial
DV haz dorsal del trigémino
GV ganglio trigémino (1ª. neurona)
GVII ganglio facial (geniculado) (1.ª neurona)
GIX ganglio superior del glosofaríngeo (1.ª neurona)
GX ganglio superior de vago (1.ª neurona)
M fibras del maxilar
MN fibras del mandibular
MU mesencefálico del trigémino (1.ª neurona propioceptiva)
NE núcleo espinal del trigémino
NR núcleo rojo
O oliva bulbar
OF fibras oftálmico
PI P fibras facial, glosofaríngeo y vago fascículo piramidal
PV N. principal del trigémino
R cinta Reil media
SAL sistema anterolateral
SN sustancia negra
TE fascículo rectoespinal
TEV tracto espinal del trigémino
VV haz ventral del trigémino
Sensibilidad aferente visceral (general y especializada) de la cabeza
VII ganglio geniculado del n. facial
IX ganglio inferior del n. glosofaríngeo
X ganglio nodoso del n. vago
CLM cinta longitudinal medial
FET fascículo espinal del trigémino
FSE fascículo solitario espinal
H hipotálamo
NA n. amígdala
NG núcleo gustativo
NS núcleo solitario
NP núcleo parabraquial
O oliva bulbar
P fascículo piramidal
Sensibilidad extereoceptiva o superficial epicrítica
Sensibilidad epicrítica del cuerpo (Fig. 5)
Permite diferenciar cualitativa y cuantitativamente los estímulos periféricos, gracias a campos receptores pequeños, receptores especializados, escasas neuronas en la vía, organización somatotópica y convergencias centrales específicas. Esto es casi aplicable a la vía de la sensibilidad térmica, dolorosa y táctil no epicrítica, pero en ella existen campos receptores más amplios, una convergencia sensorial más grande y una posible regulación supraespinal (en las láminas de origen del sistema espinotalámico terminan haces descendentes largos supraespinales). La sensibilidad táctil epicrítica y la sensibilidad a la presión profunda van por una vía totalmente distinta a la exteroceptiva difusa o protopática.
a) Receptores: terminaciones nerviosas en los bulbos pilosos, y corpúsculos de Meissner para el tacto y los corpúsculos de Paccini para la presión. Algunos admiten las terminaciones nerviosas libres finas y mielinizadas relacionadas con el dolor localizado y los discos táctiles de Merkel.
b) Primera neurona: está situada en el ganglio raquídeo; su prolongación central se situaría en la zona medial de la raíz posterior y, entrada en la médula, se integraría en el cordón posterior. Este tiene una organización laminar y somatotópica (las fibras procedentes de los niveles sacros son las más mediales y las cervicales las más laterales). Las fibras sacras y lumbares constituyen el fascículo gracilis, delgado o de Goll; las torácicas y cervicales, el fascículo cuneiforme o de Burdach. Por estos fascículos también discurre la vía de la sensibilidad propioceptiva consciente; las fibras de la sensibilidad exteroceptiva discriminativa están situadas más superficialmente que las de la propioceptiva consciente. Las fibras ascienden y terminan en la segunda neurona.
c) Segunda neurona: situada en el bulbo, a nivel de los núcleos delgado (Goll) y cuneiforme (Burdach); las sacras y lumbares, en el de Goll, y las torácicas y cervicales, en el de Burdach. En estos núcleos parecen existir neuronas que reciben información detectada por un solo tipo de receptor periférico, mientras que otras neuronas pueden recibir de varios; las primeras son muy abundantes en el núcleo cuneiforme. De ambos núcleos surgen los axones, que, decusándose, van a dar lugar al fascículo bulbotalámico o lemnisco medial o cinta de Reil media, que asciende a lo largo del encéfalo y termina en la tercera neurona.
d) Tercera neurona: situada en el núcleo ventral posterolateral del tálamo, de donde salen las fibras destinadas a la corteza cerebral de las áreas 3, 1 y 2. La sensibilidad discriminativa necesita alcanzar el área sensitiva cortical para hacerse consciente. El área sensitiva y también motora de la corteza pueden modificar los estímulos que le llegan a través de colaterales de la vía piramidal que terminan en los núcleos de Goll y Burdach.
Sensibilidad táctil epicrítica de la cabeza (Figs. 3 y 4)
Es conducida por el V, VII, IX y X pares craneales.
a) Receptores: los mismos que los del cuerpo.
b) Primera neurona: ganglios del par craneal respectivo. Sus fibras centrípetas se introducen en el tronco del encéfalo y terminan en la segunda neurona.
c) Segunda neurona: situada en el núcleo sensitivo principal del trigémino, donde sinaptan. Los axones de las células de este núcleo se integran como fibras cruzadas o directas en el haz secundario dorsal del trigémino, ascienden y terminan en la tercera neurona.
d) Tercera neurona: situada en el núcleo ventral posteromedial del tálamo y en la parte más ventral del núcleo geniculado medial. Desde aquí surgen axones tálamocervicales, que terminan en el área 3, 1 y 2, en su parte más caudal.
Sensibilidad propioceptiva
La propiocepción es el procesado de la información procedente del aparato locomotor en el sistema nervioso central. Hay dos tipos, una sensibilidad propioceptiva consciente (información de la postura corporal espacial, aceleración angular de los movimientos, y de la actividad motora) y una sensibilidad propioceptiva inconsciente (control y coordinación muscular durante la realización del movimiento).
Sensibilidad propioceptiva consciente de tronco y extremidades (Fig. 5)
a) Receptores: son los propioceptores: fibras aferentes de los husos neuromusculares (la); de los tendones (órganos tendinosos de Golgi, receptor tipo III de Skoglund); de la cápsula articular y fascias (similares a los corpúsculos de Ruffini, receptores tipo I de Skoglund); de la cápsula y huesos (similares a los corpúsculos de Paccini, receptores tipo II de Skoglund); terminaciones nerviosas, libres, no mielinizadas, en la cápsula, fascia y ligamentos (receptores tipo IV de Skoglund, parecen ser sensibles al ácido láctico y han sido interpretadas como receptores a los estímulos dolorosos). Son más numerosos en la parte distal de los miembros (dedos).
b) Primera neurona: situada en el ganglio raquídeo, su prolongación central mielinizada se sitúa en la zona medial de la raíz posterior de la médula y se introduce en el cordón posterior, donde su rama ascendente va a integrarse en los fascículos de Goll (delgado) y Burdach (cuneiforme). Su somatotopismo en sentido mediolateral es fibras sacras y lumbares (fascículo delgado), torácicas y cervicales (fascículo cuneiforme); además estas fibras se sitúan profundas con respecto a la de la sensibilidad epicrítica.
c) Segunda neurona: situada en los núcleos delgado (núcleo de Goll) y cuneiforme (núcleo de Burdach), donde existe la misma disposición somatotópica que en los fascículos. Las fibras de la sensibilidad propioceptiva terminarían en las zonas más profundas de ambos núcleos. Es de resaltar que aunque esta vía lleva la información vibratoria, no parece ser muy importante en su transmisión, ya que los estímulos vibratorios periféricos no estimulan muchas neuronas en estos núcleos.
Las fibras procedentes de estos núcleos constituyen el fascículo bulbotalámico, lemnisco medial o cinta de Reil medial, constituido por fibras cruzadas procedentes de dichos núcleos, cuya decusación constituye la denominada «decusación sensitiva» y provoca la «decapitación del asta posterior». Las fibras procedentes del núcleo de Goll (sacrolumbar) se decusan antes que las del núcleo de Burdach (toracicocervical). La cinta de Reil mantiene un somatotopismo inverso al de los cordones posteriores; a nivel del bulbo las fibras más profundas pertenecen a la región cervical y las más superficiales a las del miembro inferior; a nivel protuberancial y mesencefálico, las más laterales son las del miembro inferior y las más mediales las de la región cervical. Las fibras del lemnisco medial terminan en la tercera neurona.
d) Tercera neurona: situada en el núcleo ventral posterolateral del tálamo. Los axones de este núcleo se proyectan sobre el área 3, 1 y 2 de la corteza parietal (área sensitiva primaria).
Fig. 5
Vías de la sensibilidad propioceptiva consciente y táctil discriminativa
C fascículo cuneiforme (Burdach)
CLM cintilla longitudinal medial
FET fascículos espinotalámicos (fascículo anterolateral)
G fascículo delgado (Goll)
I miembro inferior
LM lemnisco medial (cinta Reil media)
NC núcleo cuneiforme (Burdach)
NG núcleo delgado (Goll)
NR núcleo rojo
O núcleo oliva bulbar
P fascículo piramidal
PCI pedúnculo cerebeloso inferior
R receptores
RD neurona ganglio raquídeo y raíz dorsal
Sensibilidad propioceptiva consciente de la cabeza (Figs. 3 y 4)
Los receptores periféricos son los mismos, pero la vía como alcanzan el núcleo sensitivo principal del trigémino o la parte más craneal del núcleo espinal no está claramente establecida. Para unos la primera neurona estaría en el ganglio de Gasser, al que llegarían por las distintas anastomosis que tienen los pares craneales; para otros las fibras de los otros pares craneales, una vez que han tenido su primera neurona en el ganglio correspondiente, alcanzan la segunda neurona, situada en los núcleos citados, de donde saldrían las fibras que, bien directas o bien cruzadas, se integran en el haz secundario dorsal del trigémino, que termina en el núcleo ventral posteromedial del tálamo, en la tercera neurona, desde donde surgirían los axones que alcanzarían las áreas corticales 3, 1 y 2.
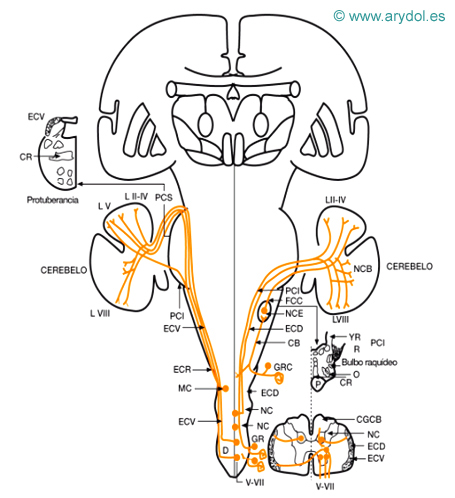
Sensibilidad propioceptiva inconsciente del cuerpo (Fig. 6)
a) Receptores: son propioceptores: fibras procedentes de los husos neuromusculares (la y II), corpúsculos tendinosos (Ib), de la cápsula articular y fascias, óseos. Lundberg indica que por esta vía también puede ascender información de receptores de presión de los folículos pilosos y de receptores de tacto y presión de la piel con vello.
b) Primera neurona: situada en el ganglio raquídeo su prolongación central, se introduce en la médula por la raíz posterior, ocupando la parte más lateral de la zona medial de la raíz. A partir de aquí existen varios fascículos (espinocerebeloso dorsal -directo o de Flechsig-, cuneocerebeloso, espinocerebeloso ventral cruzado y espinocerebeloso rostral) que conducen esta sensibilidad a los niveles superiores del sistema nervioso.
El fascículo espinocerebeloso dorsal, recoge la sensibilidad propioceptiva de las extremidades inferiores y parte inferior del tronco. Las fibras que penetran por la raíz posterior, se introducen en el cordón posterior, fascículo delgado, ascienden y realizan la sinapsis en la segunda neurona, en la columna de Clarke homolateral, lámina VII; de donde surgen los axones, que se integran en el fascículo espinocerebeloso dorsal, que está situado superficial en la zona más dorsal del cordón posterior, superficial al corticoespinal cruzado y dorsal al espinocerebeloso ventral. Este fascículo empieza a aparecer a nivel de Ll y alcanza su máximo grosor a nivel de T1. El núcleo de Clarke se extiende desde T1 a Ll. Las fibras del fascículo espinocerebeloso dorsal ascienden y, a través del pedúnculo cerebeloso inferior, alcanzan el cerebelo, el espinocerebelo, lóbulos I-IV (lóbulo anterior) paramediano y en la parte caudal de la pirámide (lóbulo VII).
El fascículo cuneocerebeloso recoge la sensibilidad propioceptiva de la parte alta del tronco y miembros superiores y cuello. Su primera neurona se sitúa en el ganglio raquídeo y sus fibras centrípetas se introducen en el cordón posterior dentro del fascículo cuneiforme; ascienden y terminan haciendo sinapsis en la segunda neurona, que se emplaza en el núcleo cuneiforme accesorio (núcleo Z) o de Monakow. Desde allí surgen axones, que se integran en el cuerpo restiforme y terminan en la corteza cerebelosa en la parte posterior del lóbulo intermedio anterior (lóbulo V), y la parte anterior del lóbulo paramediano y algunas fibras, en el vermis posterior. Este fascículo no parece llevar información táctil, ni de los folículos pilosos.
El fascículo espinocerebeloso ventral cruzado o de Gowers se integra por fibras procedentes de la primera neurona (ganglio raquídeo) que se introducen en la parte lateral de la zona medial de la raíz posterior y terminan haciendo sinapsis en la segunda neurona, situada en las láminas V a VII (principalmente VI y VII); desde ellas surge el axón que, cruzando la comisura gris, se integra en el fascículo espinocerebeloso ventral. Este está situado superficialmente en el cordón lateral, ventral al espinocerebeloso dorsal y superficial a los fascículos espinotalámicos y dorsal a la salida de las raíces anteriores. En la especie humana es muy pequeño. Este fascículo está formado por fibras procedentes de los segmentos T1 a L4. Asciende, y en el bulbo y protuberancia adquiere una disposición lateral y dorsal, estando situado superficialmente, y alcanza el cerebelo a través del pedúnculo cerebeloso superior (hay autores que afirman que un 30% de sus fibras se introducen por el pedúnculo cerebeloso inferior), terminando en la corteza cerebelosa, a nivel de las zonas anteriores del vermis del lóbulo anterior, vermis posterior y lóbulo paramediano. Un 20% a 30% de las fibras de este haz se volvería a cruzar a nivel del pedúnculo cerebeloso superior, por lo que terminarían tras dos decusaciones, en sentido contrario, en el cerebelo homolateral a su origen.
El fascículo espinocerebeloso rostral es equivalente al espinocerebeloso ventral, pero se diferenciaría de él en que su segunda neurona estaría situada en la lámina VII de los segmentos cervicales C4 a C8 (por tanto, sólo llevaría información de los miembros superiores) y además asciende homolateralmente en la médula, bulbo y protuberancia, situado ventral al fascículo espinocerebeloso ventral. Sus fibras alcanzan el cerebelo, un 20% de las mismas por el pedúnculo cerebeloso inferior y el resto por el superior, y terminan en regiones cerebelosas cercanas a las del espinocerebeloso ventral (lóbulos II-V y lóbulo VIII). En 1979 se han descrito fibras que alcanzarían el cerebelo (lóbulo I) y que procederían del núcleo cervical central (lámina VII), situado en la médula cervical (segmento C1-C4), donde estaría la segunda neurona de la información propioceptiva de la musculatura del cuello. La vía como alcanzarían el cerebelo no ha sido aclarada.
Fig. 6
Vía de la sensibilidad propioceptiva inconsciente
CB fascículo cuneiforme (Burdach)
CG fascículo delgado (Goll)
CR cinta Reil media
D decusación del espinocerebeloso ventral
ECD fascículo espinocerebeloso dorsal
ECV fascículo espinocerebeloso ventral
ECR fascículo espinocerebeloso rostral
FCC fascículo cuneocerebeloso
GR ganglio raquídeo
GRC ganglio raquídeo cervical lóbulos del cerebelo
LV
LII-IV
I-VIII lámina VII (origen espinocerebeloso rostral)
NC núcleo de Clarke
NCE núcleo cuneiforme lateral (núcleo Z)
NCB núcleos cerebelosos
O oliva bulbar
P fascículo corticoespinal
PCI pedúnculo cerebelos inferior
PCS pedúnculo cerebelos superior
R cuerpo restiforme
YR cuerpo yuxtarrestiforme
V-VII láminas de Rexed
Sensibilidad propioceptiva inconsciente de la cabeza
En esta vía los receptores son los mismos que para la vía general del cuerpo. En ellas hay que destacar los receptores de presión existentes en los dientes y en el periodontio, así como en las articulaciones alveolodentarias.
a) Primera neurona: es diferente según donde estén situados los propioceptores. Así, las de los músculos masticadores, dientes, articulaciones dentarias, articulación temporomandibular, tienen su primera neurona en el núcleo mesencefálico del trigémino. La primera neurona de los receptores situados en los territorios del facial, glosofaríngeo y vago, está en los ganglios respectivos y se introduce en el tronco del encéfalo. Los receptores de la musculatura extrínseca del ojo a través de las anastomosis de los nervios motores del ojo con el nervio oftálmico alcanzarían el núcleo mesencefálico del trigémino, donde estaría la primera neurona. Desde los ganglios del VII, IX y X pares craneales surgirían los axones que irían a la segunda neurona.
b) Segunda neurona: los axones de los ganglios del VII, IX y X terminarían en la parte más craneal del núcleo espinal del trigémino. Desde este núcleo y desde el núcleo mesencefálico del trigémino surgen los axones que van a terminar en el cerebelo.
Los procedentes del núcleo mesencefálico alcanzan el cerebelo por el pedúnculo cerebeloso superior; los del núcleo espinal del trigémino lo hacen por el cuerpo restiforme. Terminan en el cerebelo homolateral, en la parte caudal del lóbulo V y en el lóbulo VI, constituyendo la región facial del cerebelo.
Otros fascículos relacionados con las vías sensitivas:
Fascículo espinocérvicotalámico
Lleva estímulos nociceptivos cutáneos procedentes de distintas zonas del cuerpo, fundamentalmente de aquellas zonas ubicadas cerca de la línea media[14].
a) Primera neurona: estaría ubicada en el ganglio raquídeo; su prolongación central terminaría en la lámina IV de la médula, desde donde surgiría el axón que asciende homolateralmente, parece que mezcladas con las fibras del haz piramidal cruzado, y terminaría en la segunda neurona.
b) Segunda neurona: situada en núcleo cervical lateral, el cual está localizado a nivel de C1-C2, ventrolateral al asta posterior de la médula; desde aquí surgiría el axón, que se decusaría, integrándose en el lemnisco medial, para ir a terminar en la tercera neurona.
c) Tercera neurona: situada en el núcleo ventral posterolateral del tálamo. Desde aquí surgirían las proyecciones que terminarían en las áreas 3, 1 y 2. Este fascículo parece transmitir información somatotópica de estímulos cutáneos no sólo nociceptivos, sino también epicríticos (Brodal).
Fascículo espinotectal
Parece estar relacionado con la transmisión de estímulos dolorosos. Su origen a nivel medular no está aclarado. Sus fibras son cruzadas y van integradas en el fascículo espinotalámico lateral. Termina en el tubérculo cuadrigémino superior.
Fascículo espinoolivar
Está relacionado con la información propioceptiva inconsciente. La segunda neurona estaría en las láminas VII y VIII; las fibras procedentes de ellas cruzarían la línea media y ascienden; se sitúan ventrales al fascículo espinocerebeloso ventral, terminando en la tercera neurona, ubicada en los núcleos accesorios de la oliva y, desde aquí, a través del cuerpo restiforme, alcanzaría el cerebelo.
Fascículo espinorreticular o sistema espinotalámico polisináptico
Si la vía espinotalámica resultaba fundamental en los procesos discriminativos sensoriales dolorosos, la vía espinorreticular lo es en el componente afectivo-emocional del dolor. Está asociado a la transmisión de la sensibilidad somática al dolor, temperatura y táctil grosera. Es filogenéticamente antiguo y es muy sensible a los anestésicos. La segunda neurona está en las láminas I, V y VII. Las fibras de estas láminas ascienden por el cordón anterolateral del mismo lado, mezcladas con las fibras espinotalámicas, terminando en la tercera neurona, situada en los núcleos reticulares, gigantocelular del bulbo y núcleo reticular caudal de la protuberancia[15]. Desde aquí las fibras se dirigen al tálamo, donde está la cuarta neurona, en el núcleo ventral posterolateral y en los intralaminares. Desde estos núcleos se proyectaría a la corteza.
Este sistema está ligado al mantenimiento del nivel de consciencia y, por tanto, es uno de los principales componentes del sistema reticular activador ascendente.
Fascículo espinocortical
Se origina en médula cervical. Su segunda neurona no se ha localizado con exactitud (podría estar en la lámina I y V). Desde aquí las fibras ascienden mezcladas con las fibras del fascículo corticoespinal cruzado, atravesarían la línea media, a nivel de la decusación de las pirámides, y ascenderían con la vía piramidal, terminando en la corteza cerebral a nivel de las áreas donde se origina la vía piramidal, en las capas más profundas de dicha corteza. Su significación funcional no está bien aclarada.
Fascículos espinobulbar y espinoprotuberancial
Su segunda neurona, a nivel medular, no ha sido localizada; las fibras parecen ascender homolateralmente en el fascículo piramidal cruzado y terminan en la tercera neurona que está situada en el núcleo arciforme o arqueado del bulbo y en los núcleos del puente. Desde aquí las fibras alcanzarían el cerebelo; las procedentes del bulbo, a través del cuerpo restiforme; las de la protuberancia, a través del pedúnculo cerebeloso medio.
Terminarían en el vermis posterior (lóbulo VII y VIII) y en el lóbulo paramediano y los lóbulos IV-H, V-H y VI-H. Este fascículo parece transmitir información exteroceptiva al cerebelo (Tabla 2).
Tabla 2: Resumen anatomofisiológico de la sensibilidad
C. Vías nociceptivas
Aferencias centrípetas nociceptivas
La sensibilidad nociceptiva se transmite a través de las fibras finas A-delta y C y quizás también por las de tipo B. La estimulación de las fibras A-delta provocaría un dolor rápido, bien localizado y de duración corta. La estimulación de las fibras C-amielínicas produciría, en cambio, un dolor, difuso, poco localizado y más persistente.
Los cuerpos celulares (somas) de las fibras aferentes primarias que inervan los nociceptores periféricos están emplazados en los ganglios raquídeos y sus ramas centrípetas llegan a través de las raíces dorsales a la médula espinal (sustancia gris del asta posterior) donde establecen interconexiones neuronales antes de ascender hacia centros superiores. Sin embargo, el 30% de las fibras amielínicas que acceden a la médula por el asta anterior son también fibras nociceptivas, un 70% de ellas somáticas y el 30% restante viscerales.
Los nociceptores de la cara y cuello van por las ramas del nervio trigémino y alojan sus cuerpos celulares en el ganglio de Gasser. Sus ramas centrípetas entran en el tronco cerebral por el puente de Varolio y se proyectan caudalmente hasta alcanzar la sustancia gris del núcleo del trigémino.
Médula espinal
Las fibras dolorosas penetran en la médula espinal a través del fascículo de Lissauer donde se dividen en una rama ascendente y otra descendente y tras atravesar varios segmentos medulares, lo abandonan para penetrar en el asta posterior. En la médula espinal el asta anterior es el asta motora o eferente (hacia la musculatura espinal y del tronco desde su zona medial y salen las aferencias y hacia las extremidades desde su zona lateral) mientras que el asta posterior es el asta aferente (la parte más externa del asta posterior recibe aferencias exteroceptivas térmico-dolorosas y tacto-presión a nivel cutáneo, la zona media la sensibilidad propioceptiva, y la profunda la sensibilidad interoceptiva). Aunque la integración sináptica es común en la médula espinal, el asta posterior es particularmente muy rica en fenómenos sinápticos y de integración medular. Así, las vías propioespinales multisinápticas se agrupan en sistemas multisinápticos (fibras espinorreticulares y propioespinales multisinápticas) u oligosinápticos (vías espinotalámicas, espinocervicotalámicas y postsinápticas).
De las distintas vías propioespinales multisinápticas parecen estar relacionadas con la transmisión nociceptiva el tracto de Lissauer, el tracto dorsal intracornual y las fibras medulohipotalámicas.
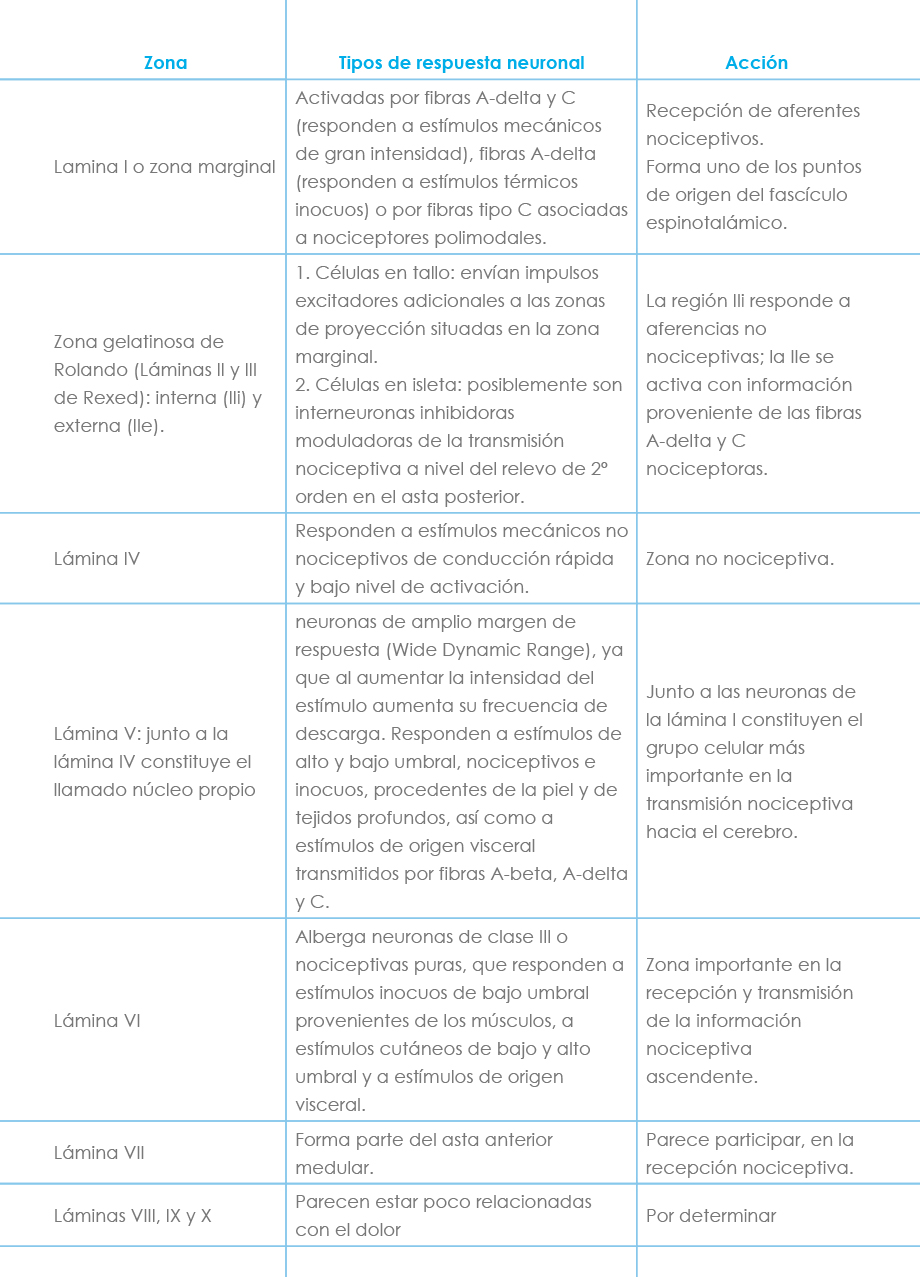
La localización neuronal medular de la sustancia gris suele explicarse conforme al esquema clásico que Rexed en 1952 describió en gatos, que establecía 10 capas o láminas, de las cuales las capas I a VI correspondían al asta posterior. Posteriormente, conforme se iban descubriendo nuevos hallazgos histofisiológicos se fue modificando esta clasificación inicial, aunque el esquema básico perdura. Así las fibras C-amielínicas parecen terminar en las láminas I, IIe, V y VI, las fibras A-delta parecen en las láminas I, IIe, V y probablemente, en la VI, las fibras A-beta parecen enviar sus colaterales a las láminas III, IV y V y las fibras A-alfa parecen enviar sus colaterales a las láminas IV y VI. Las láminas I, V y VI son fundamentalmente nociceptivas mientras que las láminas III y IV son no nociceptivas. La lámina II es nociceptiva en su capa externa y no nociceptiva en su capa interna. Las láminas I y V presentan convergencia cutaneomusculovisceral, fenómeno que parece hacerse extensivo a la lámina VI.
A nivel del asta posterior medular, la información sensorial es procesada por diferentes clases de neuronas que se clasifican en:
a) Neuronas de clase I, mecanorreceptoras, no nociceptivas: se activan exclusivamente por receptores sensoriales de bajo umbral y se encuentran sobre todo a nivel de las láminas III, IV y V.
b) Neuronas de clase II, multirreceptoras, de amplio rango o convergentes: son excitadas tanto por mecanorreceptores como nociceptores, respondiendo a una gran variedad de estímulos, inocuos o nociceptivos, procedentes de diferentes partes del organismo (piel, músculo y vísceras). Se encuentran en las capas profundas del asta posterior, aunque se han hallado también en las superficiales, en las láminas I, V y VI. Permiten discernir entre estímulos inocuos y nocivos. Parecen llevar información sobre la intensidad y localización espaciotemporal del estímulo en cuestión.
c) Neuronas de clase III, nocirreceptoras: son excitadas sólo por estímulos nociceptivos que activan los nociceptores correspondientes, por lo que se cree que ejercen un papel predominante en la señalización del carácter nociceptivo de un estímulo. Ayudan también a delimitar con exactitud el estímulo doloroso, ya que poseen campos receptores pequeños. Aparecen en las láminas I (sobre todo), IIe, V y VI. Wall postula la siguiente distribución anatómica de la sustancia gris medular (Tabla 3).
Tabla 3: Esquema de la distribución según Wall
Proyecciones al núcleo del trigémino
El patrón es similar al medular, con terminación en las láminas III a VI de las fibras mielínicas más gruesas (A-beta) y de las más finas (A-delta) y amielínicas en las capas más superficiales. Algunos receptores especializados, como los corneales o dentales, envían aferencias nociceptivas que terminan en áreas bien localizadas de los núcleos caudal e interpolar.
Vías ascendentes
La gran mayoría de las vías espinales ascendentes (no todas) llevan información nociceptiva hacia los centros superiores del sistema nervioso central. Tal como se ha demostrado experimentalmente y en caso de estudios en pacientes con lesiones medulares, se sabe que las vías ascendentes cruzadas del funículo ventrolateral son las encargadas de la conducción la práctica totalidad de la información nociceptiva, englobando los fascículos siguientes:
- Fascículo espinotalámico.
- Fascículo espinorreticulotalámico (o espinorreticular).
- Fascículo espinomesencefálico (o espinocervicotalámico).
- Fibras postsinápticas de los cordones posteriores.
- Vías propioespinales multisinápticas.
La sección quirúrgica del cuadrante ventral medular espinal (en cirugía del dolor intratable produce anestesia en el hemicuerpo contralateral inferior, pero a veces existe recuperación del dolor a través del fascículo espinocervical o los cordones posteriores.
Centros superiores del dolor
El dolor no sólo se limita a la percepción de un estímulo nocivo, sino que se acompaña de cambios de tipo afectivo (afecta la relación con los demás), conductual (quejas, absentismo laboral, cambios de comportamiento) y emocional (el sujeto relaciona su dolor actual con sucesos similares ocurridos en el pasado y lo valora positiva o negativamente). Distintas zonas del encéfalo intervienen en ese carácter multimodal del dolor. Así, el componente perceptivo se asienta, en parte, sobre la actividad cortical de las áreas somatosensoriales S1 y S2 de las regiones parietal paracentral e inferior; el afectivo involucra la actividad del sistema límbico y de las áreas de asociación frontales, el componente mnésico-cognitivo está sustentado en la porción infero-interna del lóbulo temporal y el aspecto comportamental implica la actividad del tálamo, el hipotálamo y el córtex.
Hipotálamo: El papel del hipotálamo en el dolor parece estar relacionado con la producción de estímulos aferentes hacia la sustancia gris periacueductal.
Tálamo: Es un conjunto de núcleos diencefálicos donde confluyen todas las vías sensitivas aferentes (a excepción de la olfatoria). Los núcleos talámicos implicados en el dolor son el ventroposterolateral y los núcleos intralaminares y paralaminares. Al primero llegan las aferencias de la vía neoespinotalámica y del fascículo espinocervicotalámico (análisis perceptivo de la información nociceptiva) mientras que los últimos constituyen el final de la vía paleoespinotalámica (relacionada con el dolor difuso). Además, estos núcleos sirven como estación de relevo a las vías propioespinales multisinápticas que conectan la médula con el hipotálamo.
El tálamo actúa de filtro regulador de las aferencias nociceptivas hacia el córtex cerebral e interconexiona homolateralmente a la corteza con estructuras inferiores como el hipotálamo o el sistema límbico, para actuar de modo eficaz de acuerdo con la respuesta elaborada a nivel cortical. Esto se realiza a través de fibras originadas en el núcleo ventral posterolateral, que a lo largo del brazo occipital de la cápsula interna llegan a la corteza del lóbulo parietal, a las áreas 1, 2 y 3 de Brodmann (áreas somestésicas I y II); o bien, por fibras originadas en los núcleos intralaminares que se proyectan de forma difusa a zonas tanto sensoriales como motoras, con posiblemente conexión descendente a nivel tálamo-hipotalámico y tálamo-subcortical.
Sistema límbico: Interviene en el control de la conducta, los impulsos emocionales (respuesta emotiva, centros de placer, conducta sexual, agresividad) y en la formación de la memoria. En la reacción emocional frente al dolor se encuentra involucrado, principalmente, el sistema límbico, constituido por la porción telencefálica más primitiva (hipocampo, septum y amígdala) y por formaciones más recientes (circunvoluciones del hipocampo y del cuerpo calloso, parte rostral de la corteza temporal y área inferoexterna del lóbulo temporal).
La conexión entre los sistemas afectivos y las vías de transmisión del dolor pueden ser infralímbico (control neurohormonal de sustancias endógenas de carácter algógeno, como bradiquininas, iones K+ y serotonina) o supralímbico (a partir del neocórtex, mediante los sistemas corticales moduladores de la actividad talámica, troncoencefálica y medular, principalmente sobre la formación reticular que influencia directamente las vías del dolor).
Córtex cerebral: Es el centro final de las aferencias nociceptivas y la principal responsable de las respuestas frente al dolor, ya sea a nivel perceptivo (relacionado con la actividad de las áreas somatosensoriales S1 y S2 de las regiones parietales paracentral e inferior, vehiculizado por el sistema lemniscal), afectivo (neuronas de las regiones asociativas de los lóbulos frontales, regiones cingular y orbitofrontal), mnésico (parte inferointerna del lóbulo temporal, relacionado con sectores corticales parietales y frontales a través de fibras de asociación intracorticales) y víscero-hormonal (regulada por fibras córtico-talámicas y tálamo-hipotalámicas).
MODULACIÓN DE LA TRANSMISIÓN NOCICEPTIVA
El dolor puede modularse de forma externa (tratamientos médicos, cirugía) o internamente, sobre todo mediante la aplicación de otro estímulo doloroso más intenso o en caso de estrés elevado (lucha, competición). A menudo se producen a nivel medular, con mecanismos de inhibición o de excitación cuyo balance final determina la magnitud y duración de las sensaciones dolorosas inducidas por un estímulo nocivo, ya sea por inhibición descendente o por excitación descendente[16].
Inhibición descendente
Es un mecanismo de inhibición supraespinal de la transmisión dolorosa espinal, originada en la sustancia gris periacueductal, con relevo en los núcleos del rafe y final en el asta posterior de la médula espinal17.
Excitación descendente
Actúa aumentando la excitabilidad de neuronas espinales mediante lazos de retroalimentación positiva entre la médula y el bulbo raquídeo que mantienen la actividad de las vías nociceptivas más allá del tiempo de aplicación del estímulo nociceptivo. Intervienen en los incrementos de la sensación dolorosa, de hiperreflexia espinal y de actividad vegetativa.
MECANISMOS DEL DOLOR ANORMAL
Cuando el dolor pierde su carácter de señalizador de alarma ante un estímulo nocivo, especialmente en casos de dolor crónico, cuando el dolor se torna per se en un problema de entidad propia, se habla de dolor anormal.
A menudo esto se debe a lesiones del sistema nervioso, que producen episodios de dolor anormal, ya sea por neuropatías periféricas, por dolor central o en ciertas ocasiones, por ambos mecanismos.
Neuropatías periféricas
Después de lesiones (traumáticas, diabetes) de nervios periféricos, se produce regeneración en caso que los somas neuronales permanezcan intactos. Si la recanalización nerviosa es adecuada hasta los órganos diana, la regeneración nerviosa podrá ser más o menos lenta, completa o incompleta, pero no producirá dolor anormal. En caso de una regeneración caótica, se puede formar un neuroma, que será el centro de un cúmulo de estímulos que se deben a la despolarización de las membranas plasmáticas de las fibras en regeneración y que el cerebro sigue integrando como nociceptivos (por ser fibras dañadas que inicialmente estaban conectadas a nociceptores). El resultado es la percepción de dolor espontáneo, parestesias o disestesias.
Las ramificaciones neurales de los conos de crecimiento y los somas de las fibras aferentes primarias adquieren propiedades similares a las de los receptores sensoriales periféricos originales, manifestado sobre todo como mecanosensibilidad, y en menor cuantía como termo y quimiosensibilidad. Esto explica porqué las zonas lesionadas de los nervios se transforman en mecanorreceptores sensibles especialmente a contracciones musculares, movimientos y presiones ligeras a través de la piel, y en menor frecuencia a cambios de temperatura o liberación de mediadores como la bradicinina, histamina y serotonina. Además se ha comprobado que después de una lesión periférica, las fibras aferentes primarias desarrollan una sensibilidad especialmente alta a las catecolaminas circulantes, lo cual causa que los agonistas adrenérgicos o la estimulación de eferencias simpáticas evoquen actividad en fibras nociceptivas en vías de regeneración.
Alteraciones centrales inducidas por lesiones periféricas
En ocasiones, cuando una lesión periférica se mantiene en el tiempo, llega a causar (y mantener) alteraciones nociceptivas centrales. Un ejemplo de esto es la aparición de alodinia (dolor provocado por el tacto, sensación causada por la activación de mecanorreceptores de bajo umbral que se mantiene mientras duren las descargas aferentes que provienen de nociceptores periféricos).
Dolor central
Cuando las lesiones neurológicas se producen en el sistema nervioso central, se puede producir dolor anormal central. Los casos más frecuentes se deben a lesiones medulares traumáticas sobre todo cuando abarcan niveles segmentarios superiores a L1 o causan isquemia de vías ascendentes nociceptivas tales como el fascículo espinotalámico, aunque también se han descrito en enfermedades que causan la destrucción de fibras aferentes primarias y de sus terminaciones centrales en la médula y trigémino, como en la neuralgia postherpética (por muerte de las mismas) o en la avulsión del plexo braquial (por lesiones de las raíces dorsales).
En caso del dolor central, éste se localiza en la zona periférica hiposensible o anestesiada por causa de la lesión neurológica. A diferencia del dolor neuropático provocado por lesiones de nervios periféricos, el dolor central suele ocurrir semanas o incluso meses después de la lesión neurológica causante.
En casos de dolor central intratable se ha llegado a la cirugía estereotáxica, sobre todo en la región talámica.
BIBLIOGRAFÍA
- IASP Pain terms: a current list with definitions and notes on usage. Pain 1986; (Suppl. 3): S215-S221
- Raja SN, Meyer RA, Ringkamp M, Campbell JN. Peripheral neural mechanisms of nociception. In Wall PD, Melzack R Eds. Textbook of pain (4th edition). Churchill Livingstone, Edinburgh 1999; 11-57
- Perez-Cajaraville J. Plan Maestro en abordaje integral del dolor. Ed. You&us. 2006.ISBN 84-689-6017-9
- Farmer AD, Aziz Q. Recent advances in chronic visceral pain. Curr Opin Support Palliat Care 2008; 2(2): 116-21.
- Puerta AJ, Peña A, Gil P, Prados JL, Alfonso J, Riaño M. Estudio de conjunto de las vías del sistema nervioso central. En Puerta Fonolla AJ ed. Neuroanatomía. Luzan 5 SA de ediciones. Madrid 1986; Tomo II, 317-52
- Usunoff KG, Popratiloff A, Schmitt O, Wree A . Functional neuroanatomy of pain. Adv Anat Embryol Cell Biol 2006; 184: 1-115.
- Gracely RH, Lynch SA, Bennett GJ. Painful neuropathy: altered central processing maintained dynamically by peripheral input. Pain 1992; 51(2): 175-94
- Fields HL, Heinricher MM. Anatomy and physiology of a nociceptive modulatory system. Philos Trans R Soc Lond B Biol Sci 1985; 308(1136): 361-74.
- Kiernan JA. Sistemas sensitivos generales. En: El sistema nervioso humano. London, Canadá: McGraw-Hill/Interamericana, 1998. p. 315-331.
- Treede RD, Meyer RA, Raja SN, Cambell JN. Peripheral and central mechanisms of cutaneous hyperalgesia. Prog Neurobiol 1992; 38(4): 397-421
- Cervero F, Laird JMA. Fisiología del dolor. En Aliaga L, Baños JE, Barutell C et al Editores. Tratamiento del dolor. Teoría y práctica (2ª ed.). Publicaciones Permanyer. Barcelona, 2002: 9-26
- McMullan S. Midbrain control of spinal nociception discriminates between responses evoked by myelinated and unmyelinated heat nociceptors in the rat. Pain 2006; 124(1-2): 59-68.
- Devor M, Seltzer Z. Pathophysiology of damaged nerves in relation to chronic pain. In Wall PD, Melzack R Eds. Textbook of pain (4th edition). Churchill Livingstone, Edinburgh 1999; 129-64
- Goadsby PJ, Bartsch T. On the functional neuroanatomy of neck pain. Cephalalgia 2008; 28(Suppl 1): 1-7.
- Zhang L, Zhang Y, Zhao ZQ . Anterior cingulate cortex contributes to the descending facilitatory modulation of pain via dorsal reticular nucleus. Eur J Neurosci 2005; 22(5): 1141-8
- Gebhart GF. Descending modulation of pain. Neurosci Biobehav Rev 2004; 27(8): 729-37.
- Giordano J. The neurobiology of nociceptive and anti-nociceptive systems. Pain Physician 2005; 8(3):277-90.